21 июня 2021 г.
В России разрабатывают препараты для профилактики коронавирусной инфекции на основе РНК-интерференции. Это совершенно новый подход, имитирующий внутриклеточные процессы борьбы с вирусами у растений и животных. РИА Новости рассказали об этом директор НИИ вакцин и сывороток имени И. И. Мечникова, член-корреспондент РАН Оксана Свитич и заведующий лабораторией молекулярной вирусологии, кандидат биологических наук Евгений Файзулоев.
В начале 1990-х в американской компании DNA Plant Technology попытались вывести петунии более насыщенного фиолетового цвета. Ученые вставили в ДНК растений химерный ген, усиливающий синтез природного красителя. Но, вопреки ожиданиям, более половины генномодифицированных петуний выросли белыми. Значит, нужный ген не активизировался, а наоборот, заглушался. Почему — авторы эксперимента не понимали.
Спустя несколько лет Эндрю Файр из Стэнфорда и Крэйг Мэллоу из Массачусетского университета искали гены, регулирующие раннее развитие червячка-нематоды Caenorhabditis elegans. Чтобы выключить определенный участок ДНК, делали инъекции молекул РНК.
В клетках РНК выполняют множество функций, но главная — считывание информации с ДНК, передача инструкций по синтезу белков. Такие РНК называют смысловыми. Антисмысловые РНК, наоборот, заглушают гены. Именно с ними работали Файр и Мэллоу. Они открыли и объяснили естественный механизм выключения слишком активных генов — РНК-интерференцию. За это в 2006 году их удостоили Нобелевской премии.
РНК-интерференция позволяет отключить участок генома, не редактируя его. Строго говоря, организмы, полученные таким способом, не считаются генномодифицированными. Пример — петунии звездной окраски.
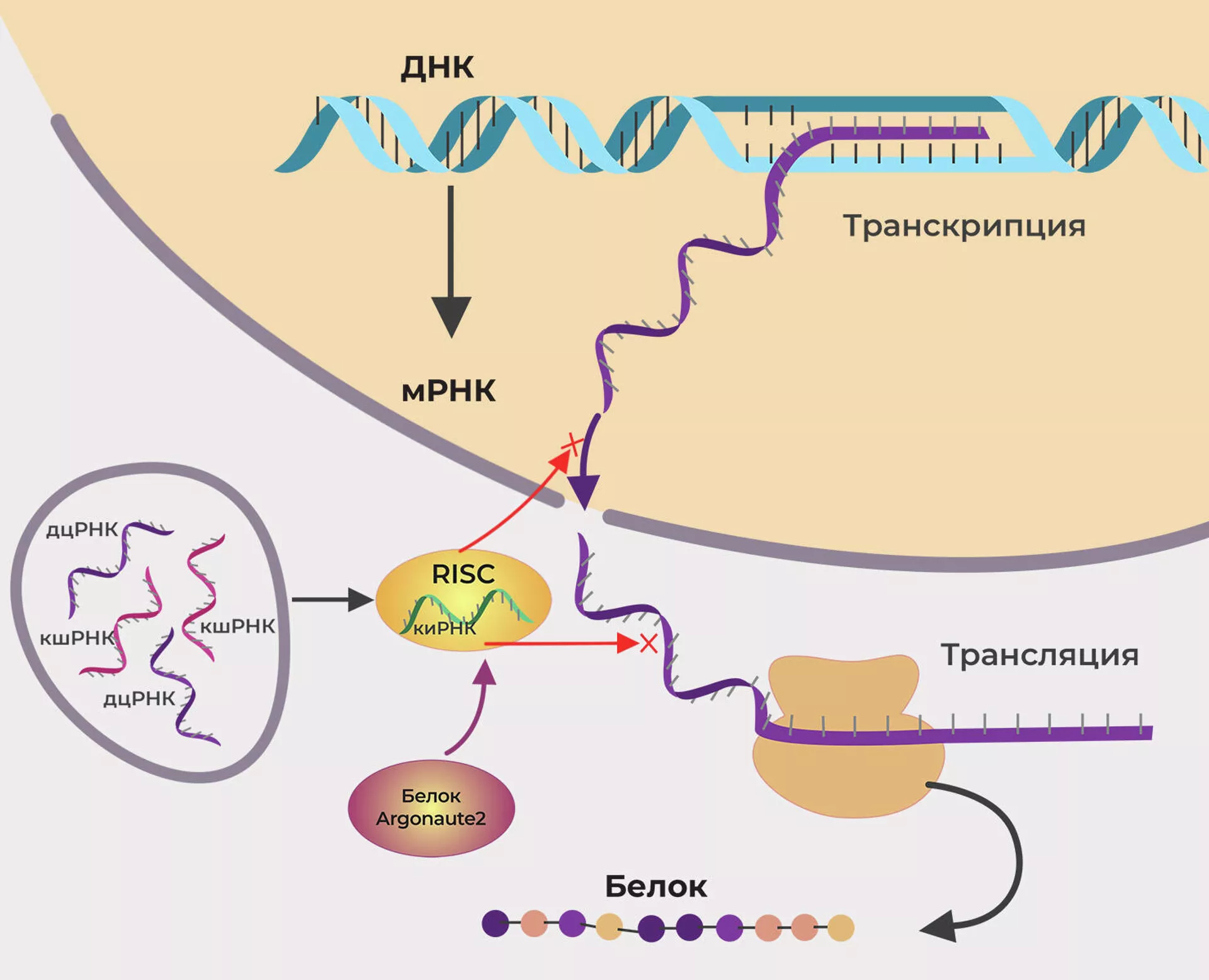
"Тут суть в подавлении экспрессии гена на стадии транскрипции или трансляции, специфичность которого определяют молекулы малых РНК, комплементарные матричным РНК (мРНК)", — объясняют ученые из НИИ вакцин и сывороток имени И. И. Мечникова.
Чтобы синтезировать белок в клетке, информация о нем переносится с определенного участка ДНК на РНК (называемую матричной). Это этап транскрипции. Затем РНК попадает в рибосому, где с нее считываются инструкции и начинается синтез белка — трансляция. Если нарушить транскрипцию или трансляцию, белок не синтезируется. Для этого нужно заслать в клетку специальную РНК, которая перехватит матричную и не даст ей нормально работать.
В организм вводят своего рода коктейль из синтетических молекул РНК, которые служат субстратом для образования коротких интерферирующих РНК (киРНК) и вместе с белками, прежде всего Argonaute2 — белками-аргонавтами, создают сложный молекулярный комплекс. РНК в нем содержат участки, комплементарные, то есть соответствующие коду матричной РНК. Комплекс связывает и нейтрализует ее. Белок не синтезируется.
"Функции РНК-интерференции изменялись вместе с эволюцией органического мира. Так, у растений, насекомых и круглых червей она формирует противовирусный иммунитет. По мере усложнения генома этот механизм все больше участвовал в регуляции транскрипции и трансляции", — отмечают эксперты.
В организме РНК-интерференцию обеспечивают два вида молекул — микроРНК и пиРНК. Установлена связь между сбоем в работе микроРНК и наследственными заболеваниями, раком, болезнями сердца и нервной системы. По данным британской базы miRBase, у человека обнаружили 1917 генов микроРНК, а у мышей — 1234. ПиРНК защищают геном от мобильных генетических элементов.
Против рака и вирусов
В РНК-интерференции сразу увидели большой потенциал практического применения. Медицина получила инструмент для лечения редких наследственных болезней, вызванных мутацией одного-двух генов.
В 2001-м ученые Института биофизической химии Общества Макса Планка (Германия) показали, что наиболее эффективны двухцепочечные РНК размером в 21 основание. Их легко синтезировать и модифицировать, что открывало широкие возможности для создания лекарств.
В 2018-м в США одобрили первый препарат на основе РНК-интерференции — патисиран для терапии транстиретинового амилоидоза. Это наследственное заболевание, при котором в клетках накапливается белок транстиретин, что ведет к смерти в детском возрасте. Если же вовремя вводить внутримышечно раствор модифицированных киРНК, развитие болезни существенно замедляется. На подходе лекарство от острой печеночной порфирии, действующее по тому же принципу.
Насекомых и круглых червей РНК-интерференция защищает от вирусов. Человека — нет, но наука способна это исправить.
Один из вариантов — выключать гены вируса, чтобы он не реплицировался внутри клетки. По этому пути пошли в Институте иммунологии ФМБА России, где разрабатывают препарат МИР-19. Однако вирусный геном быстро мутирует.
Другой способ — выключать гены в клетке, зараженной вирусом, — применили в НИИ вакцин и сывороток имени Мечникова. В этом случае можно не заботиться об эволюции конкретного штамма.
"Вирусы — это облигатные внутриклеточные паразиты. Они нуждаются в клеточных факторах и сигнальных путях для обеспечения цикла репродукции. С помощью киРНК можно эти процессы заблокировать", — уточняют ученые.
Считается, что SARS-CoV и SARS-CoV-2 легко пробивают защиту клетки за счет белков, подавляющих интерференцию РНК. В частности нуклеопротеинов N и 7а. Их гены и выбрали в качестве мишеней для киРНК. "Здесь мы рассчитываем на двойной эффект — снижение в зараженных клетках продуктов этих генов и уменьшение эффекта подавления РНК-интерференции", — добавляют собеседники РИА Новости. Другая возможная мишень — гены мембранных белков, облегчающих вирусу проникновение внутрь клетки, — ACE-2 и нейропилин 1.
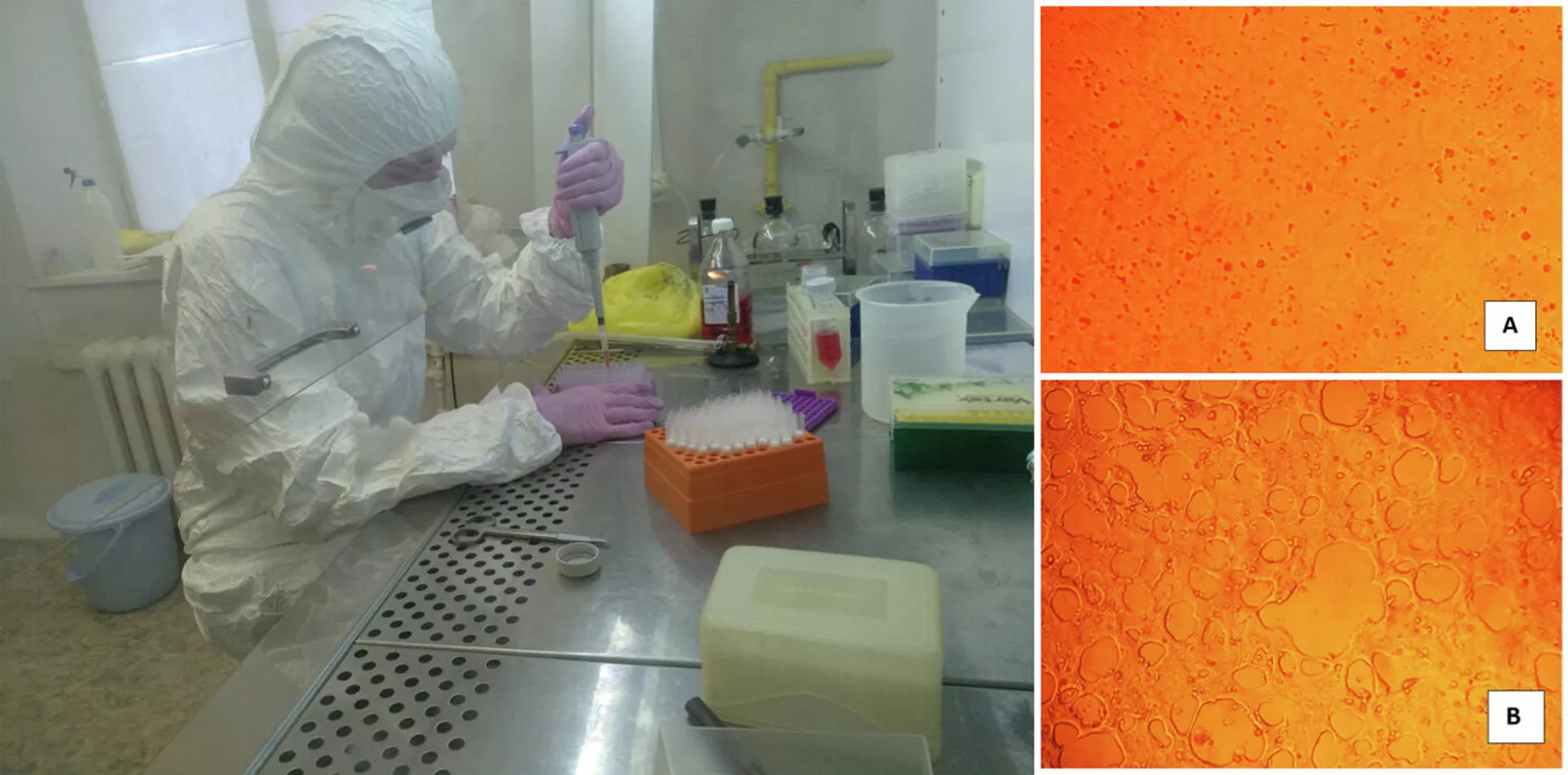
В НИИВС пока экспериментируют с клеточными линиями, зараженными различными вирусами. Результаты обнадеживают, а учитывая скорость, с которой сейчас испытывают и вводят в оборот новые лекарства, есть шанс на появление в недалеком будущем спрея от коронавируса. Достаточно обработать им носоглотку перед выходом из дома — и инфекция бессильна.

















Присоединяйтесь к нам в социальных сетях