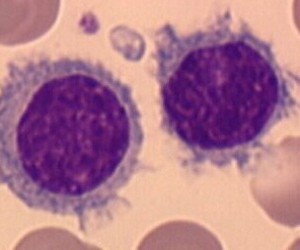
Представлены результаты исследования препарата для лечения множественной миеломы
Американские фармацевтические компании Бристол-Майерс Сквибб (Bristol-Myers Squibb Company) и ЭббВие (AbbVie Inc.) представили новые данные относительно эффективности и безопасности экспериментального моноклонального антитела элотузумаба (elotuzumab) в комбинации с леналидомидом (lenalidomide) и слабодозированным дексаметазоном (dexamethasone) у пациентов с множественной миеломой, которые до этого принимали лекарственные препараты. Клиническое испытание II Фазы было рандомизированным открытым исследованием у пациентов с множественной миеломой, которые до этого проходили лечение, в котором оценивалась терапия двух доз препарата.
Пациенты, которые принимали препарат в дозе 10мг/кг, смогли достичь средней выживаемости без прогрессирования заболевания, которая длилась 33 месяца с последующим наблюдением за пациентами 20,8 месяцев и объективным ответом в 92 процента. Во второй группе пациентов, которые принимали лекарственный препарат в дозе 20 мг/кг, шкала выживаемости без прогрессирования заболевания равнялась 18 месяцев после наблюдения за пациентами в течение 17,1 месяца с объективным ответом в 76 процентов.
Как сообщили представители компаний, в ходе исследований профиль безопасности препарата элотузумаб был постоянным. У пациентов, которые принимали элотузумаб в дозе 10 или 20мг/кг, побочные явлениями связанные с приемом препарата появлялись в течение 18 месяцев со дня начала лечения. Наиболее распространенными побочными явлениями, которые наблюдались у менее, чем пяти процентов пациентов для обеих доз препарата, были лимфоцитопения, нейтропения, тромбоцитопения, анемия, гипергликемия, пневмония, диарея, усталость и гипокалиемия. Как сообщили представители компаний Бристол-Майерс и ЭббВие, в ходе исследования препарата зафиксировано два случая летального исхода с множественными побочными эффектами – пневмонией, полиорганной недостаточностью и сепсисом.
По материалам: МЕДФАРМКОННЕКТ















Присоединяйтесь к нам в социальных сетях